 А.М. Марков Сроки восстановления критических уровней клеток крови являются важным параметром, во многом определяющим исход трансплантации гемопоэтических клеток. Длительные периоды цитопении ассоциируются с высокой вероятностью возникновения жизнеугрожающих
А.М. Марков Сроки восстановления критических уровней клеток крови являются важным параметром, во многом определяющим исход трансплантации гемопоэтических клеток. Длительные периоды цитопении ассоциируются с высокой вероятностью возникновения жизнеугрожающих  М.А. Халеев Средняя продолжительность жизни является видовым признаком: крупные виды млекопитающих обычно живут дольше мелких, хотя известны и любопытные исключения [1], указывающие на то, что старение, вероятно, контролируется отдельным молекулярно-генетическим
М.А. Халеев Средняя продолжительность жизни является видовым признаком: крупные виды млекопитающих обычно живут дольше мелких, хотя известны и любопытные исключения [1], указывающие на то, что старение, вероятно, контролируется отдельным молекулярно-генетическим Инфаркт миокарда (ИМ) является одной из ведущих причин смерти во всем мире. Золотым стандартом лечения ИМ является догоспитальный тромболизис, применение методов ургентной диагностики (коронарография), хирургическая реканализация коронарных артерий. При развитии тяжелой сердечной недостаточности (при условии, что нет стойкой легочной гипертензии, тромбофлебита, а также ряда других абсолютных противопоказаний), кардиомиопатии показана трансплантация сердца. Но, как известно, проблема трансплантологии во всем мире заключается в нехватке доноров, а также в возможных послеоперационных осложнениях: болезнь коронарных артерий пересаженного сердца (уникальная форма прогрессирующего коронарного синдрома, характеризующегося дисфункцией эндотелия и множественными очагами гиперплазии интимы, результатом чего является нарастающая обструкция коронарных артерий трансплантата) [Орлова О.В. «Роль маркеров воспаления, тромбообразования, неоангиогенеза и апоптоза в прогнозировании и развитии васкулопатии трансплантированного сердца»], реакция «трансплантат против хозяина». Поиск новых методов лечения не только принесет пользу пациентам, но и обеспечит экономическую выгоду медицинским организациям. Терапия стволовыми клетками стала одним из наиболее успешных направлений в лечении ишемической болезни сердца.
В зоне ишемии в течение 8–10 с расходуется связанный с миоглобином и физически растворенный кислород, в результате чего нарушается обмен метаболитов, прекращаются окислительно-восстановительные реакции, что приводит к гибели кардиомиоцитов (КМЦ) [Кругляков П. В., Соколова И. Б., Полынцев Д.Г.Клеточная терапия инфаркта миокарда // Цитология. — 2008. — Т. 50, No 6. —С. 521-527]. Повреждение сердечной мышцы приводит к ремоделированию миокарда — процессу последовательных адаптационных структурно-функциональных изменений, затрагивающему как зону повреждения, так и здоровый миокард. В зоне ИМ погибает большинство структурных элементов, обеспечивающих полноценное функционирование сердечной мышцы, таких как мышечные волокна, строма и сосуды. Однако при изучении возникающих рубцов в них обнаруживаются единичные гипертрофированные мышечные волокна, окруженные рубцовой тканью. Вдоль сосудов Вьессена–Тебезия или синусоидов располагаются сохранившиеся КМЦ, а также небольшие островки мышечных волокон и стромы вокруг сосудов, которые в дальнейшем играют определенную роль при замещении области инфаркта соединительной тканью, являясь своеобразными индукторами роста. Сохранение мелких островков мышечной ткани среди рубцовых полей указывает на резервные возможности миокарда [Малая Л. Т., Власенко М. А., Микляев И. Ю.Инфаркт миокарда. — М.: Медицина,1981. — 488 с.].
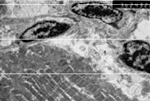 Рис.1. Электронная микрофотограмма миокарда мыши линии СВА в около инфарктной зоне 14 сутки после коронароокклюзии. Кардиомиоцит с умеренными признаками дегенерации, над которыми обнаруживаются три фибробласта, начинающих продуцировать коллагеновые волокна. Ув. 3624х.
Рис.1. Электронная микрофотограмма миокарда мыши линии СВА в около инфарктной зоне 14 сутки после коронароокклюзии. Кардиомиоцит с умеренными признаками дегенерации, над которыми обнаруживаются три фибробласта, начинающих продуцировать коллагеновые волокна. Ув. 3624х.
 Рис.2. Электронная микрофотограмма миокарда крысы в зоне развития кардиосклероза на 14 сут. после коронароокклюзии. В центре расположен фибробласт секретирующий коллагеновые волокна. Ув. 10200х.
Рис.2. Электронная микрофотограмма миокарда крысы в зоне развития кардиосклероза на 14 сут. после коронароокклюзии. В центре расположен фибробласт секретирующий коллагеновые волокна. Ув. 10200х.
Впервые кардиомиогенные свойства клеток красного костного мозга in vivo были описаны Bittner и соавт. [Bittner R. E., Schofer C., Weipoltshammer K.et al.Recruitment of bonemarrow derived cells by skeletal and cardiac muscle in adult dystrophic mdx mice // Anat. Embryol. (Berl.). — 1999. — V. 199. — P. 391–396.]. Ученые описали результаты трансплантации меченных стволовых клеток костного мозга линии мышей с мышечной дистрофией. Спустя 70 дней скопление клеток обнаружено не только в скелетных мышцах, но и в сердечной мышце. Дальнейшие более детальные исследования свойств этих клеток, обладающих способностью после ишемического повреждения миокарда становиться клетками с фенотипом кардиомиоцитов и замещать погибшие клетки сердца хозяина, были проведены Orlic и соавт. [Orlic D., Kajstura J., Chimenti S. еt al.Mobilized bone marrow cells repair the myocardiad heart, improving function and survival // Proc. Natl. Acad. Sci. USA. —2001. — V. 98. — P. 10344–10349.], что привлекло большое внимание к клеточной терапии как ученых, так и практикующих медиков.
Известно, что миокард некоторых групп животных после различных повреждений способен восстанавливаться без формирования рубца активной пролиферацией собственных КМЦ. Прежде всего это свойство присуще амфибиям, например тритонам [Brockes J. P., Kumar A., Velloso C. P.Regeneration as an evolutionary variable //J. Anat. — 2001. — V. 199. — P. 3–11.]. Замещение произведенного хирургическим путем дефекта в результате деления КМЦ при минимальном рубцевании продемонстрировано в опытах на аквариумной рыбе Danio rerio [Poss K. D., Wilson L. G., Keating M. T.Heart regeneration in zebrafish // Science. —2002. — V. 298. — P. 2188–2190.]. Предполагают, что этот процесс в некоторой степени повторяет эмбриогенез, для которого характерна последовательная экспрессия генов кардиомиоцитарной дифференцировки (Nkx-2,5, GATA-4, GATA-5, Tbx-5). Способностью восстанавливать миокард без рубцевания наделены и мыши линии MRL, т. е. млекопитающие. Их КМЦ способны вступать в S-фазу и замещать поврежденный в результате криодеструкции участок ткани миокарда [Leferavich J. M., Bedelbaeva K., Samulewicz S.et al.Heart regeneration in MRL mice //Proc. Natl. Acad. Sci. USA. — 2001. —V. 98. — P. 9830–9835].
Было установлено, что ни одна из популяций КМЦ (желудочковые, предсердные, проводящей системы) взрослых млекопитающих не является чистой популяцией необратимых постмитотических клеток. При обширных ИМ левого желудочка в предсердиях млекопитающих обнаруживается до 40% клеток, способных вступать в митоз, а в периинфарктной зоне желудочкового миокарда — около 10% Обычно реактивная репродукция КМЦ взрослых животных напоминает пролиферацию при нормальном кардиомиогенезе: лишенные миофибрилл миобласты не образуются путем дедифференцировки. Участвующие в реактивной пролиферации КМЦ зафиксированы в составе мышечных трабекул вставочными дисками и десмосомами; продолжительность митотических циклов практически равна самым длинным циклам в постнатальном кардиомиогенезе. [Румянцев П. П.Кардиомиоциты в процессах репродукции, дифференцировки и регенерации. — Л.: Наука, 1982. — 288с.]. Однако пролиферация КМЦ наблюдается в основном по периферии некротических очагов или диффузно. Митозы КМЦ, заканчивающиеся цитокинезом, редки и, следовательно, не могут заместить дефект, возникший в результате ИМ.
Благодаря использованию современных иммунофлуоресцентных и геномно-протеомных методов стало возможным идентифицировать КМЦ среди множества других типов клеток сердца и зарегистрировать в них появление специфических протеинов, участвующих в репликации ДНК [Beltrami A. P.,Urbanek K., Kajstura J. et al. Evidence that human cardiac myocytes divide after myocardial infarction // New Engl. J.Med. — 2001. — V. 344, N 23. — P. 1750–1757], что позволило исследовать процесс деления клетки без фиксирования классической картины митоза.
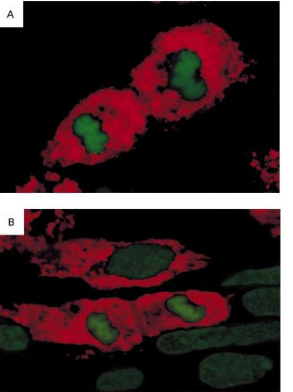 Рис.3. Митоз кардиомиоцитов, где ядро мечено иодидом пропидия (зеленая флуоресценция), а цитоплазма – АТ против альфа-актина (красная флуоресценция)
Рис.3. Митоз кардиомиоцитов, где ядро мечено иодидом пропидия (зеленая флуоресценция), а цитоплазма – АТ против альфа-актина (красная флуоресценция)
В результате морфологических исследований было установлено, что КМЦ делятся, хотя и сравнительно редко [Quaini F., Cigola E., Lagrasta C. et al.Endstage cardiac failure in humans is coupled with the induction of proliferating cele-nuclear mitotic diversion in ventricular myocytes //Circ. Res. — 1994. — V. 75. — P. 1050–1063]. С помощью современных методов исследований удалось доказать присутствие в сердце взрослого огранизма клеток-предшественников, которые, по-видимому, отвечают за фоновое обновление КМЦ в течение жизни [Anversa P., Kajstura J., Leri A., Bolli R.Life and death of cardiac stem cells: a paradigm shift in cardiac biology // Circulation. —2006. — V. 113, N 11. — 1451–1463.]. Было обнаружено, что зрелые КМЦ также могут входить в митотический цикл и делиться. Из сердца взрослого организма были получены стволовые клетки сердца (СКС), которые не только сами экспрессировали маркеры стволовых клеток, но и при культивировании in vitro давали клоны, экспрессирующие биохимические маркеры КМЦ, гладкомышечных клеток (ГМК) и клеток эндотелия [Gallo P., Peschle C., Condorelli G.
Sources of cardiomyocytes for stem cell therapy: an update // Pediatr. Res. — 2006. — V. 59,N 4. — P. 79–83.]. В работах [28, 29] также было показано присутствие в миокарде СКС, обеспечивающих регенерацию сердца после ИМ. Эти клетки не экспрессировали факторы транскрипции и структурные протеины КМЦ и гладкомышечных стволовых клеток (ГСК).
Рис.4. СКС и регенерация миокарда. А: красная флуоресценция – альфа-актин в новообразованных кардиомиоцитах. В: зеленая флуоресценция – EGFP в цитоплазме кардиомиоцитов. С: совмещенные А и В изображения. D: голубая флуоресценция – ядра кардиомиоцитов, меченные иодидом пропидия. E,F: регенерировавшая коронарная артериола
Ряд работ о возможной роли стволовых клеток в восстановлении сердечной мышцы после инфаркта представлен и в нашей стране. Исследование Л.В.Полежаева и соавт. (1965) показало, что в очаге некроза миокарда под влиянием биомодуляторов и ингибиторов рубцевания на короткий срок появлялись клетки, которые морфологически идентифицировались как слабодифференцированные миобласты.
Было констатировано также, что размеры новообразованной рубцовой ткани под влиянием указанной терапии стали значительно меньшими, чем в контроле. Происхождение «миобластов» осталось неясным. Позже Л.В. Полежаевым было показано, что миокард кроликов, пораженный дифтеритическим  токсином, восстанавливал нормальную морфологию под действием гидролизата миокарда, гомогенатов скелетных мышц и других биопрепаратов [Полежаев ЛВ. Состояние проблемы регенерации мышцы сердца. Усп Совр Биол 1995; 115:198?212.]. По мнению П.П. Румянцева (1982) [Румянцев ПП. Кардиомиоциты в процессах репродукции, дифференцировки и регенерации. Л. Наука, 1982.-288 с.], кардиомиоциты (КМЦ) не могут пролиферировать, так как строго ориентированные агрегаты сократительных белков в КМЦ создают препятствия для цитокинеза при митозе; именно поэтому для завершения его необходима обратимая разборка миофибрилл (умеренная дедифференцировка).
токсином, восстанавливал нормальную морфологию под действием гидролизата миокарда, гомогенатов скелетных мышц и других биопрепаратов [Полежаев ЛВ. Состояние проблемы регенерации мышцы сердца. Усп Совр Биол 1995; 115:198?212.]. По мнению П.П. Румянцева (1982) [Румянцев ПП. Кардиомиоциты в процессах репродукции, дифференцировки и регенерации. Л. Наука, 1982.-288 с.], кардиомиоциты (КМЦ) не могут пролиферировать, так как строго ориентированные агрегаты сократительных белков в КМЦ создают препятствия для цитокинеза при митозе; именно поэтому для завершения его необходима обратимая разборка миофибрилл (умеренная дедифференцировка).
Из-за отсутствия условий для реализации этих процессов, в частности, при ИМ митотическое деление в КМЦ обычно не идет дальше кариокинеза, и регенерация заканчивается формированием полиплоидных КМЦ. Кроме того, в ткани М не найдены структуры, подобные сателлитным клеткам скелетных мышц, которые являются незрелыми миоцитами и имеют большой потенциал к митотическому делению. Между тем, в желудочках крыс обнаруживается популяция КМЦ в количестве не более 10%, которые могут вступать в митотический цикл (накапливать 3Н?тимидин). Однакопоказано[Kajstura J, Leri A, Finato N et al. Myocyte proliferation in endstage cardiac failure in humans. Proc Natl Acad Sci USA 1998; 95:8801?8805.], что митозы КМЦ, заканчивающиеся цитокинезом, редки, располагаются в основном в периинфарктной области и, следовательно, не могут заместить дефект в результате ИМ. Д.С. Саркисов (1979) считает, что уменьшение размеров рубца, показанное в опытах Л.В. Полежаева, связано не с репаративной регенерацией, а с предотвращением вторичных волн некроза М. С позиций разработанной им теории внутриклеточной регенерации [Саркисов ДС. Регенерация и ее клиническое значение. М., Медицина, 1979.- 284 с] сердце относится к органам, в которых при повреждении преобладают не пролиферативные процессы в паренхиме, а фибропластические реакции стромы, которые почти необратимы.
могут заместить дефект в результате ИМ. Д.С. Саркисов (1979) считает, что уменьшение размеров рубца, показанное в опытах Л.В. Полежаева, связано не с репаративной регенерацией, а с предотвращением вторичных волн некроза М. С позиций разработанной им теории внутриклеточной регенерации [Саркисов ДС. Регенерация и ее клиническое значение. М., Медицина, 1979.- 284 с] сердце относится к органам, в которых при повреждении преобладают не пролиферативные процессы в паренхиме, а фибропластические реакции стромы, которые почти необратимы.
С этих позиций следует считать, что дефицит функции КМЦ в М возмещается не за счет их пролиферации, а посредством внутриклеточных гиперпластических реакций.
В исследованиях последних лет [Salvatori G, Lattanzi L, Coletta M et al. Myogenic conversion of mammalian fibroblasts induced by differentiating muscle cells. J Cell Sci 1995; 108:2733?2739.] показано, что фибробласты потенциально могут приобретать свойства клеток скелетной мускулатуры, если трансплантируются в регенерирующую скелетную мышцу. Видимо, факторами миогенного преобразования фибробластов в этих наблюдениях явились короткодистантные медиаторы регенерирующей мышцы.

Возможный вклад пролиферации КМЦ в пластические процессы М был проанализирован Kajstura et al. (1998) [Kajstura J, Leri A, Finato N et al. Myocyte proliferation in endstage cardiac failure in humans. Proc Natl Acad Sci USA 1998; 95:8801?8805.] путем измерения митотического индекса КМЦ у пациентов, перенесших трансплантацию сердца, и у больных с дилатационной кардиомиопатией. Расчеты, проведенные этими авторами, показали, что если у 45?летнего здорового человека насчитывается 5.8х109 ядер КМЦ в левом желудочке (ЛЖ), а митотический индекс КМЦ составляет 14 на 106, то 81.2х103 ядер КМЦ одновременно находятся в состоянии митоза. Длительность митоза обычно меньше 1 часа, значит, почти 0.71х109 ядер КМЦ возникает вновь в нормальном М за год в ЛЖ. Так как соотношение 1?, 2- и 4?ядерных КМЦ в ЛЖ составляет 2/1/1, то потенциальный прирост КМЦ может достигать 0.4х109 в год. По данным тех же авторов, митотический индекс КМЦ в патологическом сердце (кардиомиопатия) примерно в 10 раз выше, чем в нормальном миокарде, следовательно, пролиферация КМЦ играет важную роль в компенсаторно-восстановительных процессах патологического М.
 В 2009г. В.П.Шахов показал, что своевременная трансплантация МСК приводит к уменьшению рубца за счет протекторного влияния на клетки находящиеся в периинфарктной зоне, приводящих к улучшению сократимости и электрофизиологических свойств миокарда, а также усилению неоангиогенеза (в опыте для моделирования острого инфаркта миокарда и развития хронической сердечной недостаточности использовалась модель коронароокклюзии и криодеструкции на крысах линии Вистар. Установлено, что через 2-3 у животных формируется острая сердечная недостаточность, сопровождающаяся некрозом, деструкцией, дегенерацией рабочих кардиомиоцитов, повреждением капилляров, лейкоцитарной инфильтрацией ткани, нарушением сократительной и электрофизиологии функций сердца).
В 2009г. В.П.Шахов показал, что своевременная трансплантация МСК приводит к уменьшению рубца за счет протекторного влияния на клетки находящиеся в периинфарктной зоне, приводящих к улучшению сократимости и электрофизиологических свойств миокарда, а также усилению неоангиогенеза (в опыте для моделирования острого инфаркта миокарда и развития хронической сердечной недостаточности использовалась модель коронароокклюзии и криодеструкции на крысах линии Вистар. Установлено, что через 2-3 у животных формируется острая сердечная недостаточность, сопровождающаяся некрозом, деструкцией, дегенерацией рабочих кардиомиоцитов, повреждением капилляров, лейкоцитарной инфильтрацией ткани, нарушением сократительной и электрофизиологии функций сердца).
Результаты электронной микроскопии до и после введения МСК костного мозга, перепрограммированных в направлении кардиомиопоэза, ангиогенеза.
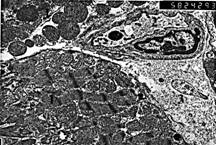 Рис.5. Электронная микроскопия миокарда мыши линии СВА в около инфарктной зоне на 7 сутки после коронароокклюзии. Фибробласт в капилляре на границе между зоной некроза и кардиомиоцитом, ув. 5824х.
Рис.5. Электронная микроскопия миокарда мыши линии СВА в около инфарктной зоне на 7 сутки после коронароокклюзии. Фибробласт в капилляре на границе между зоной некроза и кардиомиоцитом, ув. 5824х.
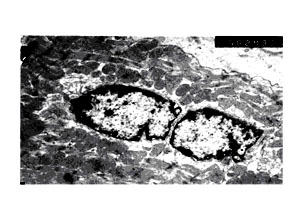 Рис.6. Делящийся кардиомиоцит в периинфарктной зоне инфаркта на фоне введения МСК, после коронароокклюзии. Электронная микроскопия, ув. 5825х (Попов, Шахов, 2004).
Рис.6. Делящийся кардиомиоцит в периинфарктной зоне инфаркта на фоне введения МСК, после коронароокклюзии. Электронная микроскопия, ув. 5825х (Попов, Шахов, 2004).
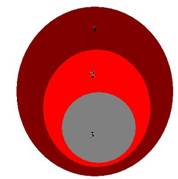
1 — непорежденный миокард, 2 — реконструированные КМЦ в периинфарктной зоне; 3 — рубцовая ткань (Шахов и др., 2009).
Таким образом, во взрослом сердце клетки, способные дифференцироваться в КМЦ, происходят либо от циркулирующих в крови клеток-предшественников, коммитированных в соответствующем кардиомиоцитарном направлении, либо от предшественников КМЦ, оставшихся в миокарде после эмбриогенеза (т. е. СКС). В связи с тем, что репаративная регенерация миокарда за счет пула собственных клеток-предшественников хотя и возможна, но происходит очень медленно, в настоящее время появился ряд новых методов, направленных на активацию регенеративных процессов в сердечной мышце. Благодаря достижениям последних лет в области клеточной терапии перспективным направлением является использование различных типов клеток, в том числе стволовых, с целью репаративной регенерации миокарда.
Клеточная кардиомиопластика становится терапией выбора по ряду причин [Репин ВС, Сухих ГТ. Медицинская клеточная биология. М., РАМН: БЭБиМ, 1998. — 200 с.]:
избежание реакции отторжения трансплантата: большинство фетальных клеток имеют слабо экспрессированные комплексы главных антигенов гистосовместимости, что на порядок уменьшает уровень посттрансплантационных осложнений
стволовые клетки имеют большой потенциал роста и пролиферации, выраженную способность к дифференцировке и функционально более активны (фетальные клетки продуцируют факторы роста и регенерации);
подсадку стволовых клеток можно регулировать по дозам и многократно повторять
эмбриональные и фетальные клетки и ткани лучше переносят тепловую ишемию и холодовую консервацию
стоимость клеточной трансплантации значительно ниже, чем пересадки органа
За последние два десятилетия различные типы клеток использовались в исследованиях на животных (эмбриональные, фетальные кардиомиоциты). На основе эмбриональных стволовых клеток (ЭСК) генетической модификацией создана линия, у которой преобладает кардиомиогенный путь дифференцировки [Klug M. G., Soonpaa M. H., Koh G. Y. et al.Genetically Selected Cardiomyocytes from Differentiating Embryonic Stem Cells Form Stable Intracardiac Grafts // J. Clin. Invest. —1996. — V. 98. — P. 216–224]. ЭСК неоднократно пытались использовать при различных патологических состояниях, но клиническое их применение пока вызывает много споров: опасность заключается в относительно высоком риске малигнизации, развитии иммунных осложнений, высокой вероятности инфицирования. Кроме того, не решены и этические аспекты этого вопроса.
При изучении возможностей стволовых клеток в организме человека применяли только скелетные миобласты и стволовые клетки костного мозга. При повреждении скелетные миобласты способны пролиферировать и сливаться с другими клетками для восстановления мышечной ткани. Также особенными характеристиками скелетных миобластов являются их аутологичное происхождение, высокая пролиферативная способность и устойчивость к ишемии. В исследованиях данные клетки принимали участие не только в восстановлении целостности сердечной ткани, уменьшении степени фиброза и апоптоза, но и в увеличении левожелудочковой фракции выброса. Однако впоследствии отмечалось частое осложнение в виде желудочковой аритмии in vitro и in vivo. Недостатками скелетных миобластов также являются длительное время культивирования и малая выживаемость клеток с низким процентом приживления в сердечную ткань.
По результатам клинического применения стволовых клеток костного мозга, их терапевтическое применение оправдано, т.к. после трансплантации наблюдается уменьшение размеров инфарктной зоны и улучшение насосной функции левого желудочка. Так, например, д-р Stefanie Dimmeler и его коллеги из Университета Гете во Франкфурте наблюдали, что через 4 месяца размеры зоны инфаркта, оцениваемые по объему замедленного заполнения, существенно уменьшилось: с 46 до 37 мл. При этом увеличилась фракция выброса левого желудочка (с 44% до 49), уменьшился его конечно-диастолический объем (с 69 до 60 мл), улучшилась сократительная способность миокарда.
Для увеличения содержания СК в аспирате костного мозга применяют методики концентрирования клеточных элементов — получение мононуклеарной фракции (МФ) [Kawamoto A., Tkebuchava T., Yamaguchi J. et al. Intramyocardial transplantation of autologous endothelial progenitor cells for therapeutic neovascularization of myocardial ischemia // Circulation. — 2003. —V. 107. — P. 461–468]. К настоящему времени проведен ряд исследований с применением МФ костного мозга. Прямые инъекции клеток МФ в зону ишемии миокарда и в артерию, питающую зону повреждения, приводили к улучшению васкуляризации ишемизированного миокарда и частичному восстановлению метаболизма поврежденного миокарда. Эти данные косвенно могут свидетельствовать об активации репарационных процессов в зоне рубца. Прямых доказательств репарации миокарда при использовании МФ не получено. Положительным аспектом применения МФ костного мозга в клинической практике является возможность работать с аутологичным материалом в условиях закрытой системы, при которой не происходит контакт клеточного материала с окружающей средой. К недостаткам МФ относят специфичность материала для каждого пациента — соотношение стволовые /прогениторные клетки сильно варьирует, вследствие чего не существует четких критериев стандартизации МФ.
Стволовые клетки костного мозга обладают следующими свойствами для использования в терапии сердечно-сосудистых заболеваний: аутологичное происхождение, доступность, способность дифференцироваться как в кардиомиоциты, так и в гладкомышечные клетки сосудов. Исследований, доказывающих дифференцировку гематопоэтических клеток в кардиомиоциты, на данный момент не обнаружено. В то время как мультипотентные мезенхимальные стромальные клетки (ММСК) под действием определенных факторов (культивирование в среде с 5-азацитидином или совместно с культурой кардиомиоцитов) приобретают фенотип кардиомиоцитов и способны к дифференцировке in vitro. Для лечения ИМ, среди всех клеток в том числе и стволовых, ММСК отличаются рядом уникальных свойств: могут доставляться к зоне повреждения через кровоток, дифференцироваться в кардиомиоцитарном направлении, являются продуцентами большого количества факторов, увеличивающих жизнеспособность клеточных элементов, в том числе КМЦ, и стимулирующих неоангиогенез. В настоящее время большинство исследователей считают применение ММСК одним из наиболее перспективных подходов в клеточной терапии ИМ. ММСК уменьшают размеры инфаркта, улучшают работу левого желудочка, способствуют ангиогенезу. Преимуществами ММСК являются их доступность, возможность развития in vitro с сохранением потенциала клеток и криоконсервации. При трансдукции с вирусом, кодирующим Akt (ген анти-апопотоза), благодаря ММСК было предотвращено ремоделирование левого желудочка, целостность миокарда была возмещена до 80%, а функция сердца восстановлена полностью. Все вышеперечисленное представляет возможным рассматривать ММСК как основной компонент клеточной терапии сердечно-сосудистых заболеваний.
 Очень важно исследование ученых ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина», в котором группам больных выполнялась трансмиокардиальная лазерная реваскуляризация миокарда в сочетании с АКШ, группы больных, которым выполнялась имплантация мононуклеарной фракции клеток костного мозга в лазерные каналы в сочетании с АКШ, и группа больных, которым выполнялось стандартное АКШ. Клинико-лабораторные исследования больных доказали безопасность клинического применения предлагаемых методов непрямой реваскуляризации миокарда. Результаты показали характерную картину ангиоваскулогенеза после имплантации стволовых клеток костного мозга в лазерные каналы (с помощью лазера создаются каналы-депо, куда вводится взвесь клеток, которые реализуют свой васкулогенный потенциал в ишемизированной ткани). Сравнительный анализ всех инструментальных данных в обеих группах непрямой реваскуляризации показал (также как и в эксперименте), что в группе с имплантацией клеток костного мозга в лазерные каналы значительно улучшилась как микроциркуляция, так и локальная сократимость в перирубцовой зоне. [А.М. Чернявский, П.М. Ларионов, А.М. Караськов. Направленныйангиоваскулогенез при хирургическом лечении ишемической болезни сердца / ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздравсоцразвития России; отв. ред. И.И. Семенов. – Новосибирск: Дизайн науки, 2011. – 151 с. ISBN 978-5-905678-02-8.]
Очень важно исследование ученых ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина», в котором группам больных выполнялась трансмиокардиальная лазерная реваскуляризация миокарда в сочетании с АКШ, группы больных, которым выполнялась имплантация мононуклеарной фракции клеток костного мозга в лазерные каналы в сочетании с АКШ, и группа больных, которым выполнялось стандартное АКШ. Клинико-лабораторные исследования больных доказали безопасность клинического применения предлагаемых методов непрямой реваскуляризации миокарда. Результаты показали характерную картину ангиоваскулогенеза после имплантации стволовых клеток костного мозга в лазерные каналы (с помощью лазера создаются каналы-депо, куда вводится взвесь клеток, которые реализуют свой васкулогенный потенциал в ишемизированной ткани). Сравнительный анализ всех инструментальных данных в обеих группах непрямой реваскуляризации показал (также как и в эксперименте), что в группе с имплантацией клеток костного мозга в лазерные каналы значительно улучшилась как микроциркуляция, так и локальная сократимость в перирубцовой зоне. [А.М. Чернявский, П.М. Ларионов, А.М. Караськов. Направленныйангиоваскулогенез при хирургическом лечении ишемической болезни сердца / ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздравсоцразвития России; отв. ред. И.И. Семенов. – Новосибирск: Дизайн науки, 2011. – 151 с. ISBN 978-5-905678-02-8.]
Сравнение свойств и эффективности различных типов клеток представлено также В.П.Шаховым в виде следующей таблицы:
Достоинства и недостатки клеточной терапии и биоматериалами (Репин, 1998; Сухих, 1998; Времель, 2004;Шахови др., 2004, 2007; 2008, 2009; Берсенев, 2005; Yamanaka, 2007; Tomoda, Yamanaka.2007; Sommeretal., 2009)
|
Источник клеток, биоматериалов |
Достоинства |
Недостатки |
Этические проблемы |
|
ЭСК |
Мультипотентность, высокий пролиферативный и дифференцировочный потенциал, получение неограниченного числа клеток и клеточных линий |
Иммунологическая несовместимость, дифференцировка клеток в другую линию, образование опухоли, развитие экстрасистолии |
Манипуляции над яйцеклеткой и бластоцистойнарушают этические проблемы |
|
ЭСК с переносом ядра донора |
Мультипотентность, высокий пролиферативный и дифференцировочный потенциал, получение неограниченного числа клеток и клеточных линий |
Дифференцировка клеток в другую линию, образование опухоли, развитие экстрасистолии |
Манипуляции над яйцеклеткой и бластоцистойнарушают этические проблемы |
|
Фетальные СК |
Высокий пролиферативный и дифференцировочный потенциал, простота получения клеток |
Иммунологическая несовместимость, возможность инфицирования клеток |
Использование фетальных СКнарушают этические проблемы |
|
ИПСК, аутологичные ( iPS-клетки) |
Мультипотентность, высокий пролиферативный и дифференцировочный потенциал |
Дифференцировка клеток в другую линию, образование опухоли |
Этических проблем нет, есть нерешенные законодательные проблемы |
|
МСК, аутологичные |
МСК не вызывают отторжения, способны дифференцироваться во многие клеточные линии |
Количество МСК снижается с возрастом, необходимость получение необходимой клеточной массы в системе invitro |
Этических проблем нет |
|
МСК аллогенные |
При наличии клеточных банков можно быстро получить необходимое количество МСК, что наиболее целесообразно применять у пожилых лиц |
Возможность иммунологического отторжения, трудность тестирования, хранения и стандартизации |
Этических проблем нет |
|
Клеточные линии |
Легкая доступность, нет временных ограничений для донора и хозяина, простота безопасного тестирования и стандартизации |
Развитие реакции отторжения, возможность образование опухоли |
Правовые и этические проблемы не решены |
Но на данный момент остаются фундаментальные нерешенные вопросы: продолжительность действия трансплантированных клеток и возможности маркировки клеток.
 На эти вопросы попытался ответить Sam Gambhir (Stanford University School of Medicine), PhD, MD, глава радиологического отделения. По его мнению, причиной неэффективности клеточной терапии, а также ее кратковременного эффекта является изначальная неправильная трансплантация клеток в сердечную мышцу. Контроль УЗИ аппаратом ведется лишь при непосредственном введении иглы в сердечную мышцу. Для успешного применения клеточной терапии важно знать точное расположение клеток в сердечной мышце, уметь оценивать жизнеспособность и функциональность клеток после трансплантации, а также выяснить, мигрируют ли клетки из очага поражения. Команда ученых во главе с Gambhir приступила к решению этих проблем.
На эти вопросы попытался ответить Sam Gambhir (Stanford University School of Medicine), PhD, MD, глава радиологического отделения. По его мнению, причиной неэффективности клеточной терапии, а также ее кратковременного эффекта является изначальная неправильная трансплантация клеток в сердечную мышцу. Контроль УЗИ аппаратом ведется лишь при непосредственном введении иглы в сердечную мышцу. Для успешного применения клеточной терапии важно знать точное расположение клеток в сердечной мышце, уметь оценивать жизнеспособность и функциональность клеток после трансплантации, а также выяснить, мигрируют ли клетки из очага поражения. Команда ученых во главе с Gambhir приступила к решению этих проблем.
Проследить за судьбой ММСК, трансплантированных в сердечную мышцу, стало возможно с помощью наночастиц, которыми метят сами клетки. Диаметр такой частицы — одна треть микрона. Одним из главных составляющих частицы является оксид кремния (SiO2), благодаря которому можно обнаружить клетки с помощью УЗИ аппарата. Было выбрано именно это инструментальное исследование по причине его высокого разрешения, способности сигнала проникать глубоко в ткани, доступности, широкого использования в клинической практике, а также возможности наблюдения за трансплантированными клетками в режиме реального времени, что выгодно отличает УЗИ от ПЭТ (позитронно-эмиссионная томография) и МРТ. Поверхность частицы покрыта гадолинием, использующегося в качестве контрастного вещества на МРТ. Томография позволяет держать под контролем состояние клеток на протяжении длительного времени.
По модифицированному методу Stober (получение сферических частиц реакцией гидролиза эфира ортокремниевой кислоты в этиловом спирте, катализатор – аммиак) было создано несколько видов наночастиц, различающихся размером (отличия достигали путем введения разного количества воды при синтезе). Для эксперимента выбраны частицы размером 300 нм, так как именно они давали сигнал силой 40 и 16 MHz. Для того чтобы индуцировать эндоцитоз, ММСК вместе с частицами культивировались в течение 7,5 часов. С помощью трансмиссионного электронного микроскопа наблюдали за распределением частиц в клетках. Энергодисперсионная рентгеновская спектроскопия (элементный анализ твёрдого вещества, базирующийся на анализе энергии эмиссии её рентгеновского спектра) показала характерный для кремния пик на 1740 ЭВ, что доказывает: затемненные области являются наночастицами.
Рис.7 А-В. Белыми стрелками показаны наночастицы, зелеными – разрывы поддерживающего матрикса из-за наночастиц, подверженных действию микротома. В белом квадрате – скопления частиц. С — клетка без наночастиц. D – результаты энергодисперсионной рентгеновской спектроскопии. Е – различная локализация частиц в ММСК (45).
ММСК способны поглощать и накапливать наночастицы без ущерба своей функциональности, продолжая реплицировать и дифференцироваться в привычном темпе. Наночастицы покрывались флуоресцентным материалом, поэтому ученые могли легко определить, сколько стволовых клеток оказалось помеченными. Примечательно, что после добавления наночастиц в культуру ММСК, было отмечено повышение продукции цитокинов: vascular endothelial growth factor (VEGF), MMP-2, stem cell factor (SCF), monocyte chemotactic protein-1 (MCP-1). В опытах на лабораторных здоровых мышах стало возможным не только установление локализации клеток, но и направление их в определенную сторону. Спустя две недели все еще удавалось получать сигнал от клеток на МРТ. Считается, что наночастицы (размером около 300 нм) агрегируют in vivo, образуя структуры с более мощным ответом на УЗ сигнал. Клетки с частицами становятся четко видимыми на 0:11с исследования в режиме реального времени. С помощью новой технологии ученые обнаружили около 70 тыс. МСК, используя УЗИ, и примерно 250 тыс. клеток на МРТ. Но такие цифры ничтожно малы по сравнению с сотнями миллионов клеток, трансплантированных в сердечную мышцу.
Никаких побочных эффектов в группе мышей, подверженных эксперименту, не наблюдалось. Дозы веществ, входящих в состав наночастиц, настолько малы, что говорить об их токсичности не приходится. Но с увеличением масштаба исследования, когда количество меченых клеток дойдет до нескольких миллионов, безусловно, необходимо повторять проверку на токсичность частиц. Также в планы ученых входит проведение аналогичного опыта на мышах с сердечной патологией.
Касательно наночастиц, ученые видят перспективу их применения в облегчении доставки генов стволовым клеткам в ишемизированный миокард, а также в получении биоматериала для создания автономных миокардиальных скаффолдов.
 Одно из последних исследований получения миокардиального скаффолда проведено в Institute of Electronic Structure and Laser (IESL), Foundation for Research and Technology Hellas (FORTH), Греция [Curr Pharm Des. 2013 Jun 18. Wharton's jelly mesenchymal stem cell response on chitosan-graft-poly(e-caprolactone) copolymer for myocardium tissue engineering. Chatzinikolaidou M, Kaliva M, Batsali A, Pontikoglou C, Vamvakaki M. Institute of Electronic Structure and Laser (IESL), Foundation for Research and Technology Hellas (FORTH), Greece]. Ученые во главе с Chatzinikolaidou Maria поставили целью создание биоскаффолда, улучшающего приживление стволовых клеток, их выживаемость и хоминг. Для этого впервые были использованы ММСК субстанции желатиноза пуповины, выгодно отличающиеся следующими свойствами [StemCell Rev. 2011 Mar;7(1):1-16. doi: 10.1007/s12015-010-9166-x. Human Wharton's jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells. Fong CY, Chak LL, Biswas A, Tan JH, Gauthaman K, Chan WK, Bongso A. Department of Obstetrics and Gynaecology, National University of Singapore, Kent Ridge, Singapore.]:
Одно из последних исследований получения миокардиального скаффолда проведено в Institute of Electronic Structure and Laser (IESL), Foundation for Research and Technology Hellas (FORTH), Греция [Curr Pharm Des. 2013 Jun 18. Wharton's jelly mesenchymal stem cell response on chitosan-graft-poly(e-caprolactone) copolymer for myocardium tissue engineering. Chatzinikolaidou M, Kaliva M, Batsali A, Pontikoglou C, Vamvakaki M. Institute of Electronic Structure and Laser (IESL), Foundation for Research and Technology Hellas (FORTH), Greece]. Ученые во главе с Chatzinikolaidou Maria поставили целью создание биоскаффолда, улучшающего приживление стволовых клеток, их выживаемость и хоминг. Для этого впервые были использованы ММСК субстанции желатиноза пуповины, выгодно отличающиеся следующими свойствами [StemCell Rev. 2011 Mar;7(1):1-16. doi: 10.1007/s12015-010-9166-x. Human Wharton's jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells. Fong CY, Chak LL, Biswas A, Tan JH, Gauthaman K, Chan WK, Bongso A. Department of Obstetrics and Gynaecology, National University of Singapore, Kent Ridge, Singapore.]:
высокая пролиферативная способность
гипоиммуногенность
не провоцируют образование тератом (отмечен низкий уровень секретируемых маркеров ЭСК: POUF1, NANOG, SOX2 and LIN28)
противоопухолевая активность (отмечена активность секретируемого IL12A, который является индуктором апоптоза)
индукция синтеза высокоподвижных ГСК
Рис.7. Поперечное сечение пуповины для гистологического исследования сразу после рождения (Г+Э). Оптимальные условия хранения согласно Netcord guidelines.
Рис.8. МСК пуповины
Wharton’s jelly-MSC (WJ-MSC) использовалась на кополимерном материале, состоящим из хитозана (CS) и поли(е-капролактона) (PCL). Оценивалась морфология, жизнеспособность, пролиферативные способность клеток на поверхности материала. С первых часов в культуре наблюдалась высокая адгезия клеток WJ-MSC и увеличение пролиферации с 3 по 7 сутки.
Автор: Юлия Орлова
Источник: celltranspl.ru
 Специалист по генетической диагностикеДорогие друзья!Наша биотехнологическая компания открывает вакансию генетика в лаборатории генетической диагностики. Лаборатория располагается в специализированном биотехнологическом комплексе и оснащена новейшим
Специалист по генетической диагностикеДорогие друзья!Наша биотехнологическая компания открывает вакансию генетика в лаборатории генетической диагностики. Лаборатория располагается в специализированном биотехнологическом комплексе и оснащена новейшим …это были выходцы из Малороссии,
которых отличали две основных черты –
чудовищное количество жизненной силы
и интерес к последним оккультным
веяниям в столице.
Виктор Пелевин, “Чапаев и Пустота”.
Прошло уже более 20 лет как пути наших стран разошлись и пройденные за это время Украиной и Россией дороги отличаются, в том числе и в области инновационных биомедицинских технологий и регенеративной медицины. Нет, сказать, что за данный отрезок времени возникли кардинальные отличия нельзя, но, как говорится, есть нюансы. За последние 3 года мне достаточно часто приходилось бывать в России в разных городах (на конференциях, курсах, проводить совместные исследования) и общаться с различными людьми, работающими в области инновационных биомедицинских технологий. И от многих мне доводилось слышать: “Вот, у вас в Украине дела обстоят лучше! У вас есть…” и следовала некая аргументация. Причем такое мнение высказывали люди, интересующиеся различными аспектами данной области: от регуляторной политики до научно-исследовательской работы и проведения клинических испытаний. Подобные слова вызывали у меня двойственные чувства: с одной стороны – гордость (любому приятно, что в его стране лучше, особенно по сравнению с Большим Братом), с другой – горькую улыбку (на то есть свои причины). А мы, выглядывая из-за своей стороны забора, завидуем объемам финансирования, Вашей технической базе, создающимся инновационным паркам и приборным паркам общего пользования. Хотя, если откровенно, то Украине действительно есть чем гордиться, начиная от ряда экспериментальных работ до нескольких прошедших клинические испытания и внедренных в клиническую практику протоколов лечения, основанных на использовании культивированных in vitro клеток.
Кроме того, есть несколько пунктов, по которым на текущий момент Украина может считаться несколько “продвинутей” России. Так у нас, в отличие от Вас, есть:
1) профильный научно-исследовательский институт в рамках Национальной академии медицинских наук Украины – ГУ “Институт генетической и регенеративной медицины”, основанный в 2007г. (http://www.igrm.kiev.ua/);
2) регуляторный орган – Координационный центр трансплантации органов, тканей и клеток МОЗ Украины (формально сайт есть — http://www.ukrtransplant.kiev.ua/, но он не работает) и некоторая правовая база:
— законодательно регламентируется проведение клинических испытаний тканевых и клеточных трансплантатов в соответствии с приказом МОЗ Украины №630 от 10.10.2007;
— осуществляется лицензирование Банков пуповинной крови, других тканей и клеток человека (под эту лицензию попадают и биотехнологические лаборатории по культивированию клеток с целью их клинического применения) в соответствии с Законом Украины “О лицензировании определенных видов хозяйственной деятельности” (статья 9, часть 3, пункт 22) и приказом МОЗ Украины №251 от 10.04.2012 “ Об утверждении Лицензионных условий осуществления хозяйственной деятельности банков пуповинной крови, других тканей и клеток человека”;
— утвержден приказом МОЗ Украины №276 от 20.04.2012 “ Перечень тканей и клеток человека, с которыми разрешена деятельность банков пуповинной крови, других тканей и клеток человека”;
— на общественное обсуждение вынесен проект беспрецедентного в мировой практике документа – “Табеля оснащения банков пуповинной крови, других тканей и клеток человека”.
Над созданием русскоязычных версий всех вышеперечисленных документов я в данный момент работаю (т.к. обещал их одному хорошему человеку) и они будут готовы в ближайшем обозримом будущем (скажем, в конце этого месяца). Если кого-то данные документы заинтересуют по каким-либо причинам – обращайтесь.
3) первые на территории СНГ официально утвержденные и зарегистрированные государством (МОЗ Украины) протоколы лечения стволовыми клетками (ради интереса — http://www.unian.net/news/555714-ukraina-lidiruet-v-sng-po-ispolzovaniyu-stvolovyih-kletok.html). Так, по крайней мере, считают разработчики данных протоколов и люди их утвердившие. Это у Вас благодаря усилиям “желтой прессы” термин “стволовая клетка” является пугалом для детей и взрослых. У нас же другая крайность. Стволовая клетка представляется в сознании обывателя как “волшебная пуля”, способная “убить” любую болезнь. Как следствие, данный термин беззастенчиво используется в рекламно-маркетинговых целях. По моему личному мнению и глубокому убеждению, стволовая клетка представляет собой в первую очередь биологический феномен, безусловно имеющий важное медицинское значение, но далеко не во всех, а лишь в ряде случаев использования клеточных препаратов в медицинских целях. И использовать словосочетание “стволовые клетки” для описания какой-либо клеточной популяции нужно обоснованно и аккуратно. А еще более обоснованным и аккуратным следует быть при утверждении того факта, что в данном конкретном методе клеточной терапии используются стволовые клетки и эффект от применения метода однозначно ими обусловлен.
В общем, по каждому из вышеприведенных пунктов есть свои “но”, но сегодня речь не об этом. Речь сегодня пойдет о событии значительном и значимом – о состоявшейся 4-5 июня 2013 г. 91-й сессии общего собрания РАМН “Клеточные технологии и регенеративная медицина”. Столь длительное вступление мне потребовалось для того, чтобы Вы, зная разницу в положении вещей в наших странах, лучше поняли мою точку зрения, мой восторг и негодование при освещении процессов, происходящих в области инновационных биомедицинских технологий в Вашей стране. И для того, чтобы подчеркнуть свою независимость. Так, будучи “громадянином незалежної країни”, я свободен от соблюдения излишних условностей и политесов при высказывании критических замечаний и могу называть вещи своими именами (Академия должна быть лидером и флагманом в научной разработке инновационных технологий и их практическим внедрении? Так с лидера и спрос особый!). Разве что больше никогда на мероприятия РАМН не пустят J. Сразу хочу подчеркнуть: данный текст не претендует на то, чтобы быть истиной в последней инстанции. Это всего лишь субъективное восприятие одного конкретного индивидуума. И те критические замечания, которые будут высказаны, не нацелены на то, чтобы обидеть или оскорбить. Их цель – указать на недочеты, которые бросились мне в глаза. И у каждого есть выбор – принять их к сведению, обсудить, проигнорировать, или с негодованием их отвергнуть.
Итак, приступим: “правду говорить легко и приятно”!
Общие впечатления.
Сам факт того, что сессия РАМН была посвящена клеточным технологиям и регенеративной медицине говорит о перспективности и важности данного направления. Да, действительно, регенеративная медицина по праву может считаться медициной будущего, и мы с Вами свидетели и соучастники того, как Будущее становится Настоящим. При этом надеюсь, что у Вас и в Академии и в Министерстве понимают, что медицина будущего может появиться и успешно развиваться только на базе сильной традиционной, “классической” медицины. Хирурги и терапевты, педиатры и фтизиатры, инфекционисты и стоматологи также должны получать адекватное внимание и финансирование (я имею в виду расходы на образование, курсы повышения квалификации, проведение конференций, зарплату и т.д.).
Сама сессия вызвала большой интерес и была проведена на очень достойном уровне. Организаторам удалось разместить большое количество участников, задействовав три зала – в одном можно было “в живую” наблюдать за выступлением докладчиков, в двух других выступления транслировались на экраны телевизоров. При этом и картинка, и звук были отличными. В первый день было два момента, когда с экрана пропадало изображение (видимо, это было обусловлено настройками передающей аппаратуры), но неполадки были быстро ликвидированы. Конечно, 91-я сессия РАМН, как и любое другое событие или явление в нашей жизни имело свои позитивные и негативные моменты. Причем “негативные моменты” это даже сильно сказано. Скорее осталась возможность для улучшения, совершенствования. И большей частью это касается не организаторов, а докладчиков. Какие плюсы и минусы выделил бы я.
Плюсы. Представленные доклады были очень разнообразными как по форме, так и по содержанию: фундаментальные и практические, экспериментальные и клинические, обзорные и представляющие результаты собственных исследований и т.д. Были охвачены почти все основные направления регенеративной медицины и инновационных биомедицинских технологий: клеточная терапия (были затронуты почти все основные клеточные типы, имеющие потенциальное или реальное медицинское значение), генно-терапевтический и фармакологический подходы регенеративной медицины, новые диагностические и комплексные решения. Очень удачным оказался выбор приглашенных докладчиков – Prof. M.D. Antony Atala (США, директор Wake Forest Institute for Regenerative Medicine; главный редактор журнала Stem Cells Translational Medicine) и сотрудниц университетского медицинского комплекса Charite (Берлин, Германия) Prof. Dr. Petra Reinke (член руководящего комитета) и Nina Babel (заместитель заведующего клиники для амбулаторного лечения пациентов с почечным трансплантатом), которые представили доклад по общей тематике, состоящий из двух частей (доклинической и клинической).
Минусы. Слабо были представлены регионы. Так, если навскидку, в Самаре и Нижнем Новгороде есть учреждения, имеющие большой клинический опыт использования клеточных и тканевых трансплантатов. Очень удивило отсутствие доклада из Краснодара (Центр регенеративной медицины Кубанского медицинского университета). Ведь организацией получен Мегагрант Правительства РФ, над реализацией проекта работает несколько ученых с мировым именем, сотрудники прошли стажировку в Karolinska Institute (Стокгольм, Швеция), успешно прооперированы несколько пациентов, ведется экспериментальная работа. Разве нечего рассказать, нечего послушать? Не приглашали? Сами не подавали доклад и не хотели выступить на профильной сессии РАМН? Мне кажется, здесь кроется какая-то тайна! В итоге тема тканевой инженерии оказалась вообще не затронутой (не считая доклада Anthony Atala). Также минусом считаю отсутствие докладов по эмбриональным стволовым и индуцированным плюрипотентным стволовым клеткам, хотя работа с данными клеточными типами в России, насколько мне известно, ведется. Кроме того, если я не ошибаюсь, то в РФ есть несколько официально зарегистрированных и внедренных в практику клеточных (и не только) технологий, которые прошли путь от доклинической экспериментальной работы через клинические испытания в клинику. Так почему же было не пригласить с докладом кого-то, уже прошедшего этот тернистый путь? Из технических моментов несколько удивило отсутствие в первый день переводчика на докладе немецких коллег, ведь их доклад не был экспромтом – он был в программе (хотя, не знаю, что меня больше удивило – отсутствие переводчика, или озвученная необходимость его присутствия при условии использования докладчиком английского языка). Они сами с блеском справились с пикантной ситуацией. Оказалось, что одна из них прекрасно владеет русским языком, а вторая все очень четко рассказала на английском.
В целом, повторюсь, мероприятие было проведено достойно, на очень хорошем уровне. В итоге присутствующим удалось получить представление о текущем состоянии, последних достижениях, проблемах и перспективах развития регенеративной медицины в РФ, а также познакомиться с мировым опытом прослушав доклады зарубежных коллег.
Я искренне признателен тому человеку, благодаря которому мне удалось посетить данное мероприятие!!!
Вступление. Проблемы и перспективы.
Открыл 91-ю сессию РАМН Президент РАМН, академик РАН и РАМН Иван Иванович Дедов. Затем с приветственным словом к присутствующим обратилась Вероника Игоревна Скворцова – Министр здравоохранения РФ, член-корреспондент РАМН. В своих выступлениях они рассмотрели текущее состояние, проблемы и перспективы развития регенеративной медицины в России. Эти вопросы в своих докладах также затронули академик РАМН Владимир Павлович Чехонин и академик РАМН Геннадий Тихонович Сухих. Если суммировать, то основными проблемами, препятствующими развитию регенеративной медицины в РФ, были признаны следующие:
— отсутствие законодательной базы (приято, что под этим подразумевалось не только отсутствие принятого закона “О применении биомедицинских технологий в медицинской практике”, но и говорилось о необходимости работы над созданием документов “более низкого уровня” – отраслевых стандартов, регламентов и других подзаконных актов);
— отсутствие необходимой производственной инфраструктуры для развития инновационных биомедицинских технологий (т.е. собственного производства специализированного научного и медицинского оборудования, реактивов и расходных материалов);
— отсутствие производственных площадок для создания клеточных и иных продуктов;
— отсутствие в структуре РАМН специализированного центра/института по клеточным технологиям и регенеративной медицине;
— отсутствие профессиональной ассоциации специалистов, работающих в области регенеративной медицины;
— отсутствие адекватной системы подготовки кадров в области регенеративной медицины.
Какие шаги для решения вышеперечисленных проблем были или будут предприняты? Прозвучало следующее:
— закон “О применении биомедицинских технологий в медицинской практике” будет в ближайшее время внесен в последней редакции на рассмотрение в Правительство РФ и с высокой вероятностью он в данной редакции будет принят (так, по крайней мере, было сказано);
— будет создано несколько специализированных Центров по регенеративной медицине в структуре РАМН;
— было объявлено о государственной регистрации некоммерческой организации Межрегиональная общественная организация “Национальное общество регенеративной медицины”, рассказано о структуре Общества (предполагается создание нескольких региональных отделений) и его целях. Также было названо руководство данного Общества (Сухих Г.Т., Ткачук В.А., Чехонин В.П.) и озвучен состав Президиума (детальнее в презентации академика РАМН Сухих Г.Т.).
Касательно последнего момента мне интересно, как новообразованное Общество будет взаимодействовать с “Межрегиональной общественной организацией специалистов по клеточным технологиям и регенеративной медицине”, существующей с 2008г.? Тем более, что ряд персоналий имеет отношение к обеим организациям.
От себя добавлю еще несколько моментов, которые, как мне кажется, являются проблемными в развитии инновационных биомедицинских технологий в РФ:
— имитационный характер большинства проводимых на данный момент в России исследований в данной области. Под этим я подразумеваю то, что многие исследования представляют собой повторение уже сделанных на Западе работ. Само по себе это не является проблемой, а скорее представляет естественный и неминуемый этап в развитии, связанный с необходимостью ликвидировать отставание в методологии, возникшее в переходной период от одной общественно-экономической формации к другой. Проблема заключается в другом. Повторить исследование можно по-разному: расставить по-другому акценты, взглянуть на вопрос под другим углом, или даже логически его продолжить. На текущий же момент, как мне кажется, большинство такого рода работ в России не только не несет в себе ничего нового по сравнению с западным оригиналом, но часто даже не дотягивает до него либо по уровню технического выполнения, либо по части понимания того, что делается и зачем это делается. Т.е. проблемой является низкое качество имитационных исследований и отсутствие оригинальных идей;
— отсутствие общей терминологии, что приводит к неправильному и/или неуместному употреблению уже существующих терминов, либо необоснованным попыткам “придумать” свой новый термин. Кто-то скажет: “не велика беда!”. Позволю себе не согласиться. С появлением второй сигнальной системы изменился и процесс мышления. Он стал основываться на речи, на словах (наверное, мало кто будет спорить с тем фактом, что большинство из нас предпочитает абстрактно-логическое мышление образному). А термины представляют собой особый тип слов, к которым предъявляются специфические требования. На мой взгляд, любой термин должен быть: 1) значимым (т.е. нести определенную смысловую нагрузку); 2) обоснованным (касательно биологических и/или медицинских терминов имеется в виду то, что они должны отражать реально существующий процесс, феномен, явление и т.д.); 3) четким (т.е. не допускать двусмысленной трактовки). Неудачная терминология – прямой путь к спутанному и бессвязному мышлению. И 91-я сессия РАМН может “похвастаться” рядом примеров из области неудачного или неправильного использования терминов;
— элементы нездоровой конкуренции (долго пытался подобрать слова и нечего лучше не придумал) – живущие в РФ и работающие в области регенеративной медицины люди лучше меня знают, понимают и способы описать те явления, которые я назвал этими словами. Я бы отнес к нездоровой конкуренции следующее: попытки ограничить количественный и качественный состав участников тех или иных событий и процессов с использованием административного ресурса; закулисные игры вокруг Закона “О применении биомедицинских технологий в медицинской практике”; ограничение доступа к получению федеральных грантов для частных компаний (формально никаких ограничений нет, но фактически такое происходит даже при подаче совместного проекта с академическими учреждениями – об этом я слышал/знаю от нескольких сотрудников различных частных компаний из разных городов и регионов России) и т.д. Мне кажется, что подобный подход затруднит создание и успешное функционирование малых инновационных предприятий (о которых так много последнее время у Вас говорят) и коммерционализацию биотехнологических продуктов (стремление к чему повсеместно декларируется).
В общем, на первый взгляд проблем хватает. Тем не менее, при правильном подходе и надлежащих усилиях российское научное сообщество вполне может и должно их преодолеть!
Автор: Роман Васильев
Источник: celltranspl.ru